หมายถึง
พันธะในสารประกอบที่เกิดขึ้นระหว่างอะตอม 2
อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีใกล้เคียงกันหรือเท่ากัน
แต่ละอะตอมต่างมีความสามารถที่จะดึงอิเล็กตรอนไว้กับตัว
อิเล็กตรอนคู่ร่วมพันธะจึงไม่ได้อยู่ ณ
อะตอมใดอะตอมหนึ่งแล้วเกิดเป็นประจุเหมือนพันธะไอออนิก หากแต่เหมือนการใช้อิเล็กตรอนร่วมกันระหว่างอะตอมคู่ร่วมพันธะนั้นๆและมีจำนวนอิเล็กตรอนอยู่รอบๆ
แต่ละอะตอมเป็นไปตามกฎออกเตต
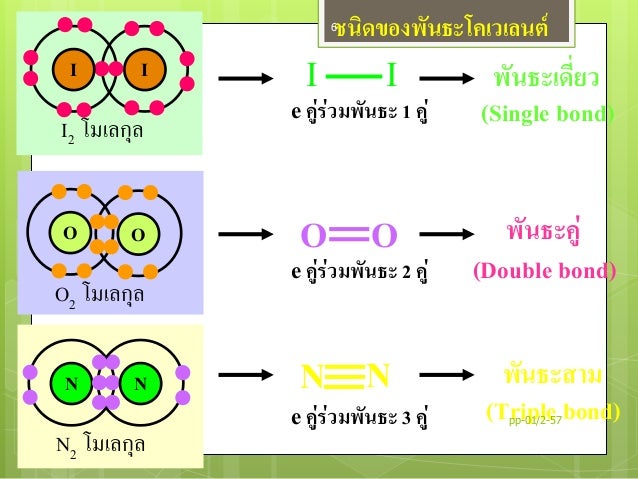
เกิดจากการใช้อิเล็กตรอนข้างนอกร่วมกันระหว่างอะตอมของธาตุหนึ่งกับอีกธาตุหนึ่งแบ่งเป็น
3 ชนิดด้วยกัน
1. พันธะเดี่ยว (Single covalent bond )เกิดจากการใช้อิเล็กตรอนร่วมกัน 1 อิเล็กตรอน เช่น F2 Cl2 CH4 เป็นต้น
2. พันธะคู่ ( Doublecovalent
bond ) เกิดจากการใช้อิเล็กตรอนร่วมกันของธาตุทั้งสองเป็นคู่ หรือ 2
อิเล็กตรอน เช่น O2 CO2 C2H4 เป็นต้น
3. พันธะสาม ( Triple covalent
bond ) เกิดจากการใช้อิเล็กตรอนร่วมกัน 3 อิเล็กตรอน
ของธาตุทั้งสอง เช่น N2 C2H2 เป็นต้น
สารประกอบที่ไม่เป็นไปตามกฎออกเตต
กฎออกเตต กล่าวว่า อะตอมของธาตุต่างๆที่มีเวเลนซ์อิเล็กตรอนไม่ครบ
8 มีแนวโน้มที่จะปรับตัวให้มีเสถียรภาพมากขึ้นโดยรวมตัวกันเองหรือรวมตัวกับอะตอมของธาตุอื่นในสัดส่วนที่ทำให้แต่ละอะตอมมีเวเลนซ์อิเล็กตรอนเท่ากับ
8 หรือมีจำนวนอิเล็กตรอนเท่ากับแก๊สเฉื่อย
สารประกอบโคเวเลนต์ไม่เป็นไปตามกฎออกเตต
1. สารประกอบที่ไม่ครบออกเตต
คือ สารประกอบของ Be และ B
2. สารประกอบที่เกินออกเตต
คือ อะตอมของธาตุในโมเลกุลที่มีเวเลนต์อิเล็กตรอนมากกว่า 8 ได้แก่
สารประกอบของธาตุคาบที่ 3 หมู่ที่ 4 เป็นต้นไป
3. สารประกอบที่มี
e- โดดเดี่ยวเป็นเลขคี่ จะเรียกว่า อนุมูลอิสระ
การเรียกชื่อสารประกอบโคเวเลนต์
1. ให้เรียกชื่อของธาตุที่อยู่ข้างหน้าก่อนแล้วตามด้วยชื่อของธาตุที่อยู่ด้านหลังโดยเปลี่ยนเสียงพยางค์ท้ายของธาตุเป็น-ไอด์(-ide)
ดังตัวอย่างดังต่อไปนี้
ไฮโดรเจน (H) ออกเสียงเป็น ไฮไดรต์
คาร์บอน (C) ออกเสียงเป็น คาร์ไบด์
ไนโตรเจน (N) ออกเสียงเป็น ไนไตรด์
ฟลูออรีน (F) ออกเสียงเป็น ฟลูออไรด์
คลอรีน (CI) ออกเสียงเป็น คลอไรต์
ออกซิเจน (O)ออกเสียงเป็น ออกไซต์
คาร์บอน (C) ออกเสียงเป็น คาร์ไบด์
ไนโตรเจน (N) ออกเสียงเป็น ไนไตรด์
ฟลูออรีน (F) ออกเสียงเป็น ฟลูออไรด์
คลอรีน (CI) ออกเสียงเป็น คลอไรต์
ออกซิเจน (O)ออกเสียงเป็น ออกไซต์
2. ระบุจำนวนอะตอมของธาตุไว้หน้าชื่อธาตุโดยวิธีการระบุจำนวนอะตอมของธาตุจะระบุโดยใช้ชื่อตัวเลขในภาษากรีก
ดังนี้
1 = มอนอ (mono)
2 = ได (di)
3 = ไตร (tri)
4 = เตตระ (tetra)
5 = เพนตะ (penta)
6 = เฮกซะ (hexa)
7 = เฮปตะ (hepta)
8 = ออกตะ (octa)
9 = โนนะ (nona)
10 = เดคะ (deca)
2 = ได (di)
3 = ไตร (tri)
4 = เตตระ (tetra)
5 = เพนตะ (penta)
6 = เฮกซะ (hexa)
7 = เฮปตะ (hepta)
8 = ออกตะ (octa)
9 = โนนะ (nona)
10 = เดคะ (deca)
แต่มีข้อยกเว้น คือ
ไม่ต้องมีการระบุจำนวนอะตอมของธาตุที่อยู่ด้านหน้าในกรณีที่ธาตุที่อยู่ด้าน
หน้ามีอยู่เพียงอะตอมเดียว
และไม่จำเป็นต้องมีการระบุจำนวนอะตอมของธาตุในกรณีที่ธาตุที่อยู่ด้านหน้า
เป็นธาตุไฮโดรเจน ไม่ว่าจะมีกี่อะตอมก็ตาม
ตัวอย่างการเรียกชื่อสารประกอบโคเวเลนต์
N2O5Nเรียกว่า ไดโนโตรเจนเพนตะออกไซด์
N2Oเรียกว่า ไดโนโตรเจนมอนอกไซด์
CCI4เรียกว่าคาร์บอนเตตระคลอไรด์
SO2เรียกว่าซัลเฟอร์ไดออกไซด์
COเรียกว่า คาร์บอนมอนนอกไซด์
CO2เรียกว่า คาร์บอนไดออกไซด์
H2Sเรียกว่า ไฮโดรเจนซัลไฟด์
ความยาวพันธะ หมายถึง ระยะระหว่างจุดศูนย์กลางของนิวเคลียสของอะตอมทั้งสองที่เกิดพันธะกัน
(หน่วยเป็น Angstrom , 10-10 m , A0 )
อะตอมไฮโดรเจน 2 อะตอมเข้าใกล้กันเป็นระยะทาง 74 พิโคเมตร ซึ่งเป็นระยะทางที่เหมาะสมในการเกิดพันธะโคเวเลนต์ระหว่างไฮโดรเจน
โดยระยะนี้เรียกว่า "ความยาวพันธะ" ทั้งนี้ความยาวพันธะระหว่างอะตอมคู่เดียวกันในโมเลกุลของสารต่างชนิดกัน
จะมีค่าไม่เท่ากัน เช่น
สาร
|
สูตรโมเลกุล
|
ความยาวพันธะ O-H (pm)
|
น้ำ
|
H2O
|
95.8
|
เมทานอล
|
CH3OH
|
95.6
|
ดังนั้น
ความยาวพันธะระหว่างอะตอมคู่หนึ่ง จึงหาได้จากค่าเฉลี่ยของความยาวพันธะระหว่างอะตอมคูjเดียวกันในโมเลกุลต่างๆ
เมื่อกล่าวถึงความยาวพันธะ โดยทั่วไปจึงหมายถึง “ความยาวพันธะเฉลี่ย”
ความสัมพันธ์ระหว่างความยาวพันธะกับพลังงานพันธะ
ความยาวพันธะและพลังงานพันธะ
จะสามารถเปรียบเทียบกันได้ก็ต่อเมื่อเป็นพันธะที่เกิดจากอะตอมของธาตุคู่เดียวกัน
ถ้าเป็นอะตอมต่างคู่กันเทียบกันไม่ได้
ดังนั้น
ถ้าความยาวพันธะยิ่งสั้น พลังงานพันธะก็จะยิ่งมาก หรือพันธะมีความเสถียรมาก
ซึ่งจากรูปเราสามารถสรุปได้ ดังนี้
ความยาวพันธะ พันธะเดี่ยว > พันธะคู่ > พันธะสาม
พลังงานพันธะ พันธะสาม > พันธะคู่ > พันธะเดี่ยว
แนวคิดเกี่ยวกับเรโซแนนซ์
การเกิดเรโซแนนซ์ คือ
ปรากฏการณ์ที่ทำให้สามารถเขียนโครงสร้างลิวอิสได้มากกว่า 1 แบบ
ซึ่งการเกิดเรโซแนนซ์จะทำให้โมเลกุลมีเสถียรภาพเพิ่มขึ้น
โครงสร้างที่แสดงการเกิดเรโซแนนซ์ เรียกว่า โครงสร้างเรโซแนนซ์
โครงสร้าง ค. เป็นโครงสร้างเรโซแนนซ์ผสม(resonance hybrid
structure) ที่เป็นตัวแทนของโครงสร้างเรโซแนนซ์ ก. และ ข.
อาจกล่าวได้ว่า
ไนโตรเจน และออกซิเจนใน NO2 ใช้อิเล็กตรอนร่วมกัน 1.5 คู่
และเมื่อเขียนโครงสร้างเรโซแนนซ์ ค. จะใช้เส้นประแทนคู่อิเล็กตรอนที่เคลื่อนที่ไปมา
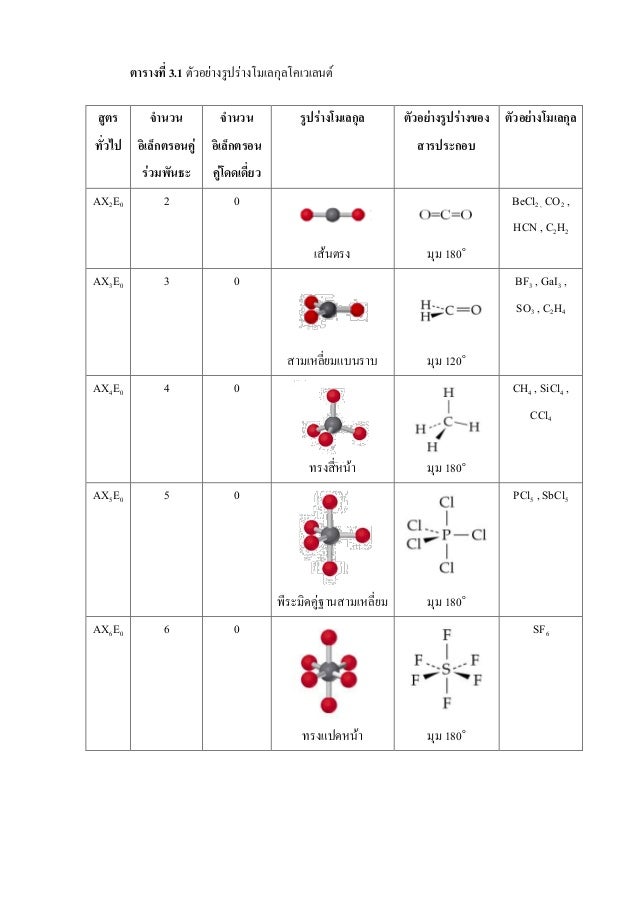
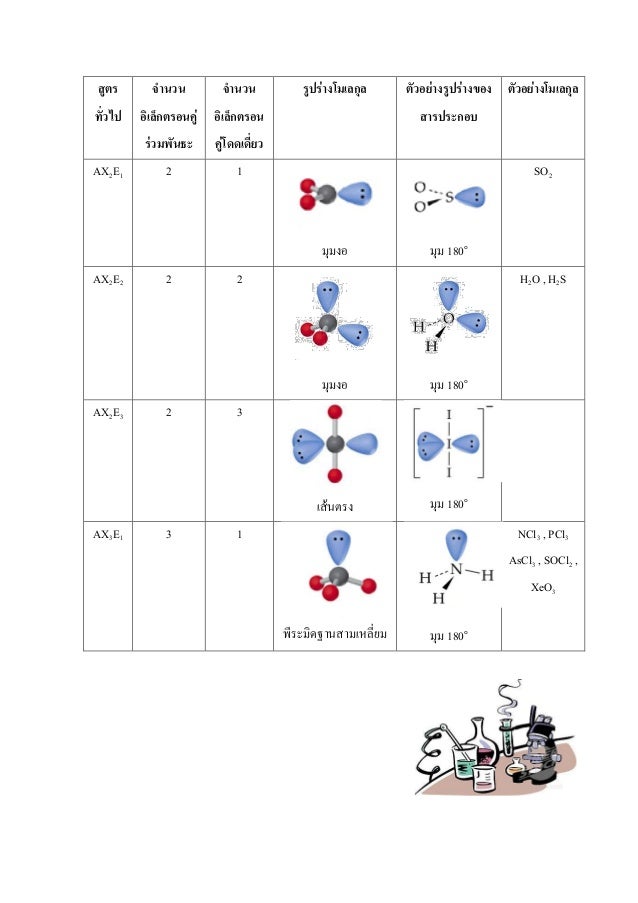
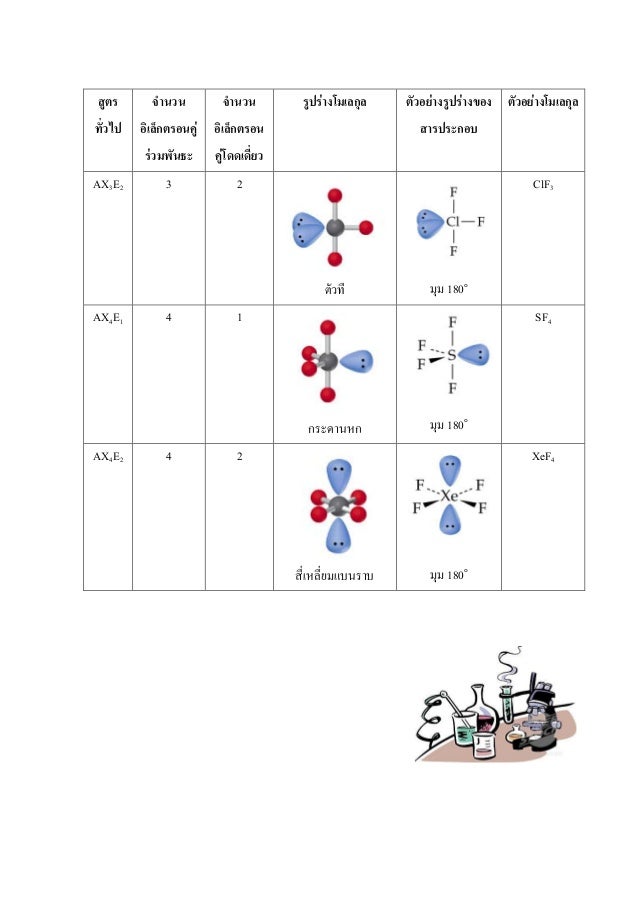
ตารางรูปร่างโมเลกุล
สภาพขั้วของโมเลกุลโคเวเลนต์
จากการศึกษาสารโคเวเลนต์ที่เกิดจากอะตอมชนิดเดียวกัน เช่น พบว่าอิเล็กตรอนคู่ร่วมพันธะจะกระจายอยู่รอบๆ
อะตอมทั้งสองเท่ากัน พันธะที่เกิดขึ้นในลักษณะเช่นนี้เรียกว่า พันธะโคเวเลนต์ไม่มีขั้ว
แต่ในสารโคเวเลนต์ที่เกิดจากอะตอมต่างชนิดกันและมีค่าอิเล็กโทรเนกาติวิตีแตกต่างกัน
เช่น HCIอิเล็กตรอนคู่ร่วมพันธะจะใช้เวลาอยู่กับอะตอม CI ซึ่งมีค่าอิเล็กโทรเนกาติวิตีมากกว่าอะตอมของ H ทำให้อะตอมCI แสดงอำนาจไฟฟ้าค่อนข้างลบ ส่วน H มีค่าอิเล็กโทรเนกาติวิตีต่ำกว่าจะแสดงอำนาจไฟฟ้าค่อนข้างบวก
พันธะที่เกิดขึ้นลักษณะเช่นนี้เรียกว่า พันธะโคเวเลนต์มีขั้ว
แรงยึดเหนี่ยวระหว่างโมเลกุลโคเวเลนต์
สารโคเวเลนต์มีทั้งที่เป็นของแข็ง ของเหลว หรือแก๊สที่อุณหภูมิห้อง ในสถานะของแข็งอนุภาคของสารจะอยู่ชิดกันและมีแรงยึดเหนี่ยวต่อกันสูง แต่ในสถานะของเหลวอนุภาคจะอยู่ห่างกัน แรงยึดเหนี่ยวที่มีต่อกันน้อยลง และในสถานะแก๊สจะมีแรงยึดเหนี่ยวต่อกันน้อยมาก โมเลกุลของแก๊สจึงอยู่ห่างกัน เมื่อให้ความร้อนแก่สารจนถึงจุดหลอมเหลวหรือจุดเดือด อนุภาคของสารจะมีพลังงานสูงพอที่จะหลุดออกจากกัน และเกิดการเปลี่ยนสถานะได้จากปริมาณความร้อนที่ใช้เพื่อการเปลี่ยนสถานะของสาร ทำให้เราทราบว่าสารในสถานะของแข็งมีแรงยึดเหนี่ยวระหว่างอนุภาคสูงกว่าสารชนิดเดียวกันในสถานะของเหลว และสารในสถานะของเหลวมีแรงยึดเหนี่ยวระหว่างอนุภาคสูงกว่าในสถานะแก๊สดังนั้น จุดหลอมเหลวและจุดเดือดของสารจึงเป็นข้อมูลใช้พิจารณาเปรียบเทียบแรงยึดเหนี่ยวระหว่างอนุภาคของสารได้จุดหลอมเหลวและจุดเดือดของสารบางชนิด
สารโคเวเลนต์มีทั้งที่เป็นของแข็ง ของเหลว หรือแก๊สที่อุณหภูมิห้อง ในสถานะของแข็งอนุภาคของสารจะอยู่ชิดกันและมีแรงยึดเหนี่ยวต่อกันสูง แต่ในสถานะของเหลวอนุภาคจะอยู่ห่างกัน แรงยึดเหนี่ยวที่มีต่อกันน้อยลง และในสถานะแก๊สจะมีแรงยึดเหนี่ยวต่อกันน้อยมาก โมเลกุลของแก๊สจึงอยู่ห่างกัน เมื่อให้ความร้อนแก่สารจนถึงจุดหลอมเหลวหรือจุดเดือด อนุภาคของสารจะมีพลังงานสูงพอที่จะหลุดออกจากกัน และเกิดการเปลี่ยนสถานะได้จากปริมาณความร้อนที่ใช้เพื่อการเปลี่ยนสถานะของสาร ทำให้เราทราบว่าสารในสถานะของแข็งมีแรงยึดเหนี่ยวระหว่างอนุภาคสูงกว่าสารชนิดเดียวกันในสถานะของเหลว และสารในสถานะของเหลวมีแรงยึดเหนี่ยวระหว่างอนุภาคสูงกว่าในสถานะแก๊สดังนั้น จุดหลอมเหลวและจุดเดือดของสารจึงเป็นข้อมูลใช้พิจารณาเปรียบเทียบแรงยึดเหนี่ยวระหว่างอนุภาคของสารได้จุดหลอมเหลวและจุดเดือดของสารบางชนิด
พันธะโคเวเลนต์แบบโครงผลึกร่างตาข่าย
อโลหะส่วนใหญ่อยู่ในรูปโมเลกุลเดียว มีจุดหลอมเหลว จุดเดือดต่ำ
แต่อโลหะบางชนิดมีจุดหลอมเหลว และจุดเดือดสูง บางชนิดนำไฟฟ้าได้อีกด้วย สารพวกนี้
ได้แก่ สารที่มีโครงสร้างแบบโครงผลึกร่างตาข่าย
สารพวกนี้อะตอมยึดเหนี่ยวกันด้วยพันธะโควาเลนต์รูปแบบต่อเนื่องกันคล้ายตาข่ายสามมิติบ้าง
สองมิติบ้าง สารพวกนี้ไม่มีสูตรโมเลกุล เขียนได้แต่สูตรอย่างง่าย
สารพวกนี้ได้แก่ คาร์บอนในรูปเพชร แกรไฟต์ และฟลูเลอรีน ฟอสฟอรัสในรูปของ
ฟอสฟอรัสขาว ฟอสฟอรัสแดง และฟอสฟอรัสดำ นอกจากนั้นยังมีสารประกอบบางชนิดก็เป็นสารโครงผลึกร่างตาข่าย
เช่น ซิลิก้า หรือซิลิคอนไดออกไซด์ (SiO2) ซิลิคอนคาร์ไบด์
หรือคาร์บอรันดัม (SiC)





ไม่มีความคิดเห็น:
แสดงความคิดเห็น